Die molekulare Ätiologie des Hennekam-Syndroms
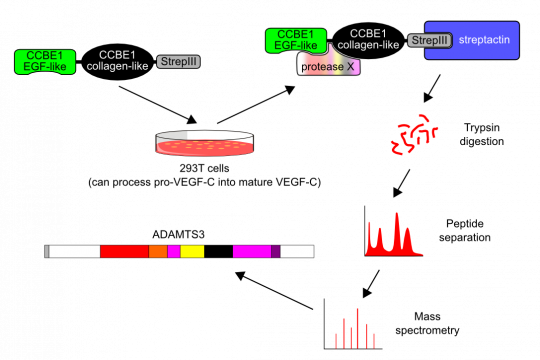
Endlich ist unser CCBE1-Manuskript zur Veröffentlichung angenommen worden. Es kann von der Webseite des Journals Circulation heruntergeladen werden (oder schick mir einfach eine E-Mail). Ein dazu komplementärer Artikel von Le Guen et al. aus Ben Hogans Gruppe erschien fast zeitgleich in Development. Le Guen und seine Kollegen haben die Interaktion von CCBE1 mit der Signaltransduktion von VEGF-C/VEGFR-3 hauptsächlich auf der genetischen Ebene in Zebrafischen beschrieben, während wir die molekularen Details der Interaktion mittels in vitro- (in Zellkultur) und in vivo-Analysen (in Mäusen) aufgeklärt haben. Wir haben herausgefundenm das der primäre Lymphangiognese-Faktor VEGF-C als inaktives Vorläufermolekül produziert wird (pro-VEGF-C). Pro-VEGF-C (die 29/31-kDa-Form) bindet zwar den VEGF-Rezeptor-3 auf Endothelizellen, aber kann ihn nicht aktivieren. Bisher wurde pro-VEGF-C im Vergleich mit dem reifen VEGF-C einfach nur als weniger potententer Aktivator des VEGF-Rezeptor-3 betrachtet. In Wirklichkeit ist er aber ein kompetitiver Inhibitor des reifen VEGF-Cs. Die Aufgabe von CCBE1 besteht darin, der Metalloproteinase ADAMTS3 bei der Prozessierung von zelloberflächen-gebundenem pro-VEGF-C zu helfen. In der Erbkrankeit Hennekam-Syndrom ist CCBE1 mutiert und kann diese Helferfunktion nicht mehr ausreichend wahrnehmen. Dies resultiert in einer ungenügenden Aktivierung des pro-VEGF-C und damit zum charakteristischen Lymphödem des Syndroms. Weil Lymphgefässe in vielen Krankheiten eine Rolle spielen, sind CCBE1 und ADAMTS interessante Zielstrukturen für pharmakologische Interventionen. Z. B. wäre es von erheblichem Nutzen, wenn man die Aktivierung von pro-VEGF-C bei Krebserkrankungen blockieren könnte, weil sich dadurch wahrscheinlich die von VEGF-C vermittelte Metastasierung über das Lymphsystem unterdrücken lassen müsste.